서론
줄기세포(stem cell)는 미분화 상태의 세포로 자가복제(self-renewal)를 할 수 있으며 환경에 따라 특정 기능을 가진 세포로 분화할 수 있는 능력(differentiation potential)을 가지고 있는 만능세포이다. 줄기세포는 손상된 세포로 분화하여 정상 세포로 재생시키는 기능뿐 아니라 면역 체계를 구성하는 다양한 면역 세포의 기능을 조절하여 만성 염증을 조절할 수 있는 능력을 가지고 있다고 보고되었다.1) 줄기 세포의 이러한 특징과 정맥 투여 시 조직 손상이 있거나 염증이 있는 부위로 스스로 찾아갈 수 있는 호밍 효과(homing effect) 때문에 다양한 임상 질환에서 장기 및 조직의 손상에 대한 기능 회복을 목표로 활발한 연구가 진행되고 있으며, 줄기 세포의 발달로 인류는 새로운 양상의 의료 형태를 꿈꾸게 되었다.
줄기세포는 기원하는 조직의 종류에 따라 배아줄기세포(embryonic stem cell)와 성체줄기세포(adult stem cell)로 분류할 수 있다. 성체줄기세포는 배아줄기세포에 비해 종양의 발생 가능성이 적고 윤리적인 문제를 피할 수 있어 다양한 질환에 세포 치료로 활발히 연구되고 있으며, 여기에는 조혈줄기세포(hematopoietic stem cell), 중간엽줄기세포(mesenchymal stem cell), 신경줄기세포(neural stem cell) 등이 있다. 중간엽줄기세포는 중배엽에서 기원한 연골, 골조직, 지방조직, 골수의 기질(stroma) 등에 존재하는 줄기세포를 의미한다. 골수줄기세포(bone marrow stem cell)가 가장 먼저 알려졌지만 채취 시의 통증과 많은 양의 줄기세포 획득이 불가한 단점이 있다. 지방줄기세포(adipose-derived stem cell, ASC)는 손쉽게 많은 양을 얻을 수 있고 골수줄기세포에 비해 쉽게 배양되고 증식 속도도 빠르고 세포노화현상도 늦게 일어난다는 장점이 있다.2) 중간엽줄기세포는 다양한 형태의 세포로 분화할 수 있는 능력뿐 아니라 T세포, B세포, 그리고 수지상 세포(dendritic cell)의 증식과 기능을 억제하여 면역 조절효과를 가지고 있다고 보고되었다.3) 하지만 중간엽줄기세포 자체를 이용한 치료법은 체외 배양 과정 중 발생할 수 있는 인수 전염의 문제, 상대적으로 큰 세포 크기로 인한 혈관폐쇄유발경색 및 뇌혈관장벽에 의한 이동 불가 문제, 비이상적 증식 및 분화로 인한 악성 종양형성 및 부적절한 조직 형성 가능성, 줄기세포의 생체 내 낮은 생존율 등의 심각한 한계가 있다.
최근 줄기세포 치료 효과가 질환 부위로 이동한 이식된 줄기세포에서 분비되는 여러 물질들이 중요한 역할을 한다고 보고되면서, 줄기세포 응용 치료 분야에서 줄기세포에서 분비되는 여러 물질에 대해 많은 연구가 이루어지고 있다. 중간엽줄기세포가 병변 부위에 노출되었을 때 미세환경(microenvironment)에 반응하여 다양한 치료 물질을 분비하며, 이러한 다양한 물질들이 병변 부위를 회복시키는 작용을 줄기세포의 주변 영양효과(paracrine effect)라고 한다. 줄기세포 분비체(secretome)는 줄기세포에서 외부로 방출되는 모든 물질의 총체를 말하며 여기에는 세포외 소포체(extracellular vesicles), 단백질, 핵산, 작은 분자 물질들이 포함된다. 줄기중간엽줄기세포에서 자가분비유도(autocrine induction) 또는 주변분비유도(paracrine induction)로 분비되는 물질들은 혈관생성인자(angiogenic factors), 성장과 영양 인자(growth and trophic factors), 케모카인(chemokines), 전염증성 사이토카인(pro-inflammatory cytokine), 항염증 사이토카인(anti-inflammatory cytokines)를 포함하고 있다.4) 이에 저자들은 현재 비과 영역 중 난치성이라고 알려진 알레르기 비염과 천식, 후각 장애 및 호산구성 비용을 동반한 만성 비부비동염에서 지방유래 줄기세포와 지방줄기세포 유래 세포외 소포체를 이용하여 진행하고 있는 저자들의 연구 결과들을 소개하고 임상적인 적용에 대해 보고하고자 한다.
본론
알레르기 비염과 천식은 동일한 병인을 가지고 있는 대표적인 아토피성 질환으로 알레르기 비염 환자의 30%가 천식을, 천식 환자의 70%에서 알레르기 비염을 동반할 정도로 서로 밀접하게 연관되어 있어 “united airway disease”라고 할 수 있다. 알레르기 비염과 천식은 다양한 원인 항원과 이에 대한 특이 면역글로불린 E에 의해 발생하며, 면역학적으로 호산구의 유출과 Th2 세포의 활성화를 특징으로 한다. 즉 알레르겐에 특이적인 Th2 면역반응으로 Th2 세포에서 분비되는 interleukin(IL)-4, IL-5, IL-13과 같은 사이토카인에 의한 만성 호산구성 염증이다.1,3,4) 조절 T세포는 T세포의 분화와 활성화를 조절하며 Th1과 Th2 반응을 모두 억제하여 두 반응 사이의 억제적인 균형을 유지하는 역할을 한다. 조절 T세포에서 분비되는 IL-10, TGF(transforming growth factor)-β는 Th2 반응을 증가시키는 IL-4, IL-5, IL-13, 그리고 Th1 반응을 증가시키는 IFN(interferon)-γ를 억제하는 역할을 한다고 알려져 있다. 최근에는 알레르기성 기도 질환의 병인에서 Th1/Th2 반응의 불균형뿐 아니라 조절 T세포의 불완전한 억제가 과도한 Th2 반응에 중요한 역할을 한다고 보고되었다.1,3,4)
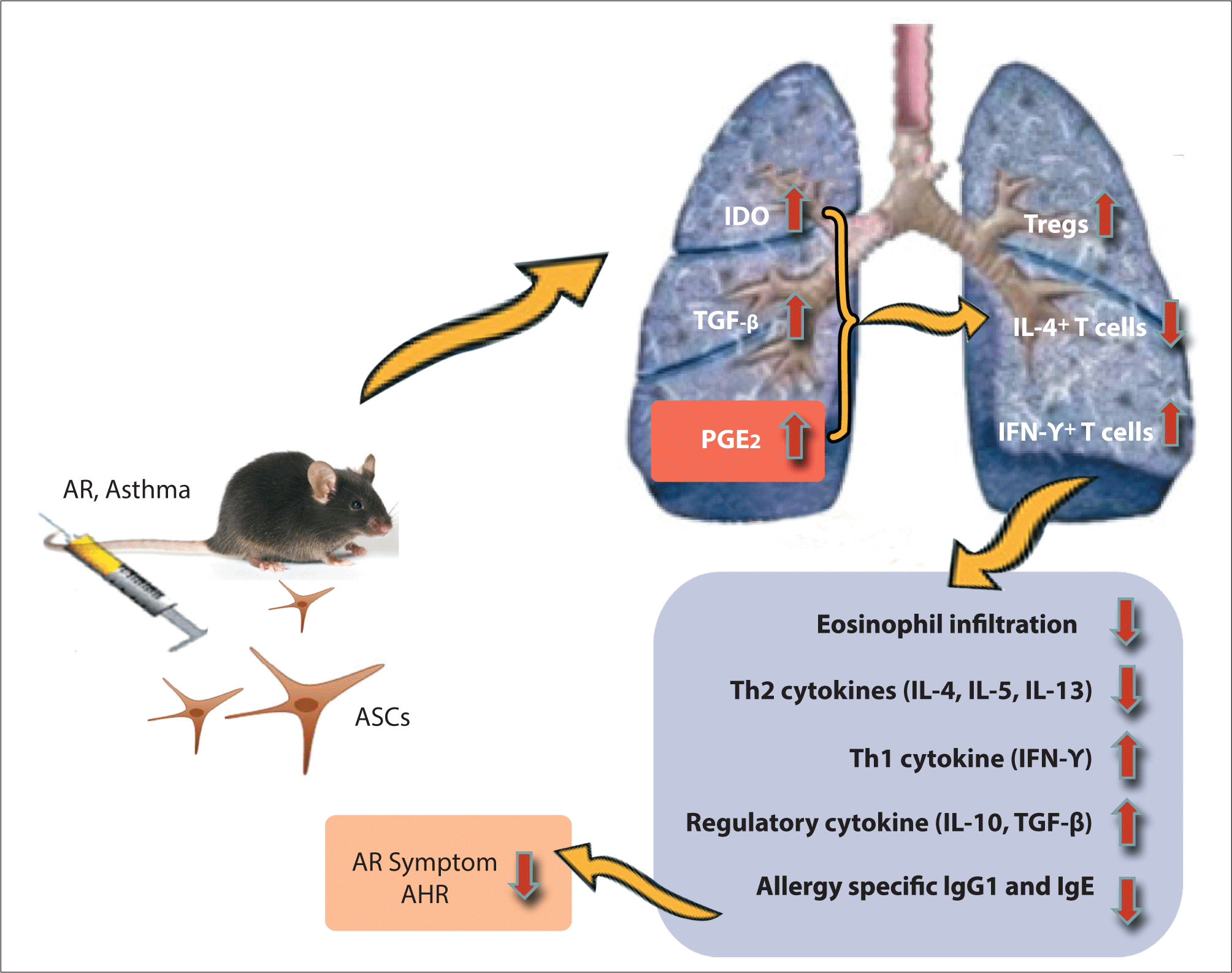
마우스의 지방 조직에서 중간엽줄기세포를 분리 배양하여 알레르기비염 및 천식 마우스 모델에 정맥 주사하였을 때 줄기세포가 알레르기 염증이 있는 부위로 찾아가는 호밍 효과로 비강 점막 및 폐 조직에서 더 많이 발견되는 것을 확인하였다.5,6) 지방유래 줄기세포는 재채기와 코를 비비는 동작과 같은 알레르기비염 증상과 메타콜린에 대한 기도과민성을 호전시켰으며, 비강 점막 및 폐 조직에서 호산구의 침윤을 감소시켰다. 또한 알레르겐 유발 후 기관지 폐포 세척액과 폐 주위 림프절(lung draining lymph nodes)에서 증가한 IL-4, IL-5, IL-13와 같은 Th2 사이토카인, 면역글로불린 E를 감소시키며, 조절 T세포와 조절 사이토카인의 증가를 유도하였다고 보고하였다.5,6) 이에 대한 기전으로 정맥으로 주입된 지방유래 줄기세포가 폐로 이동하여 indoleamine 2,3-IDO(dioxygenase), TGF-β, PGE2(prostaglandin E2)의 분비를 촉진하고, 이는 조절 T세포의 증가와 IL-4 양성 T세포의 감소, 그리고 IFN-γ 양성 T세포를 증가시켜 결과적으로 폐 조직에서 호산구의 침윤과 IL-4, IL-5, IL-13과 같은 Th2 사이토카인 그리고 알레르겐 특이 면역글로불린 E와 G1을 감소시키고, Th1 사이토카인과 IL-10, TGF-β와 같은 조절 사이토카인을 증가시킨다고 알려졌다(Fig. 1).7,8) PGE2 길항제와 TGF-β 중화항체를 사용하여 PGE2와 TGF-β의 기능을 차단한 경우 지방줄기세포로 치료를 하더라도 줄기세포에 의한 면역조절효과가 나타나지 않아 알레르기 기도 질환의 치료에 지방줄기세포에서 분비되는 PGE2와 TGF-β와 같은 가용성 인자(soluble factor)들이 중요한 역할을 한다는 것을 알 수 있었다.9,10)
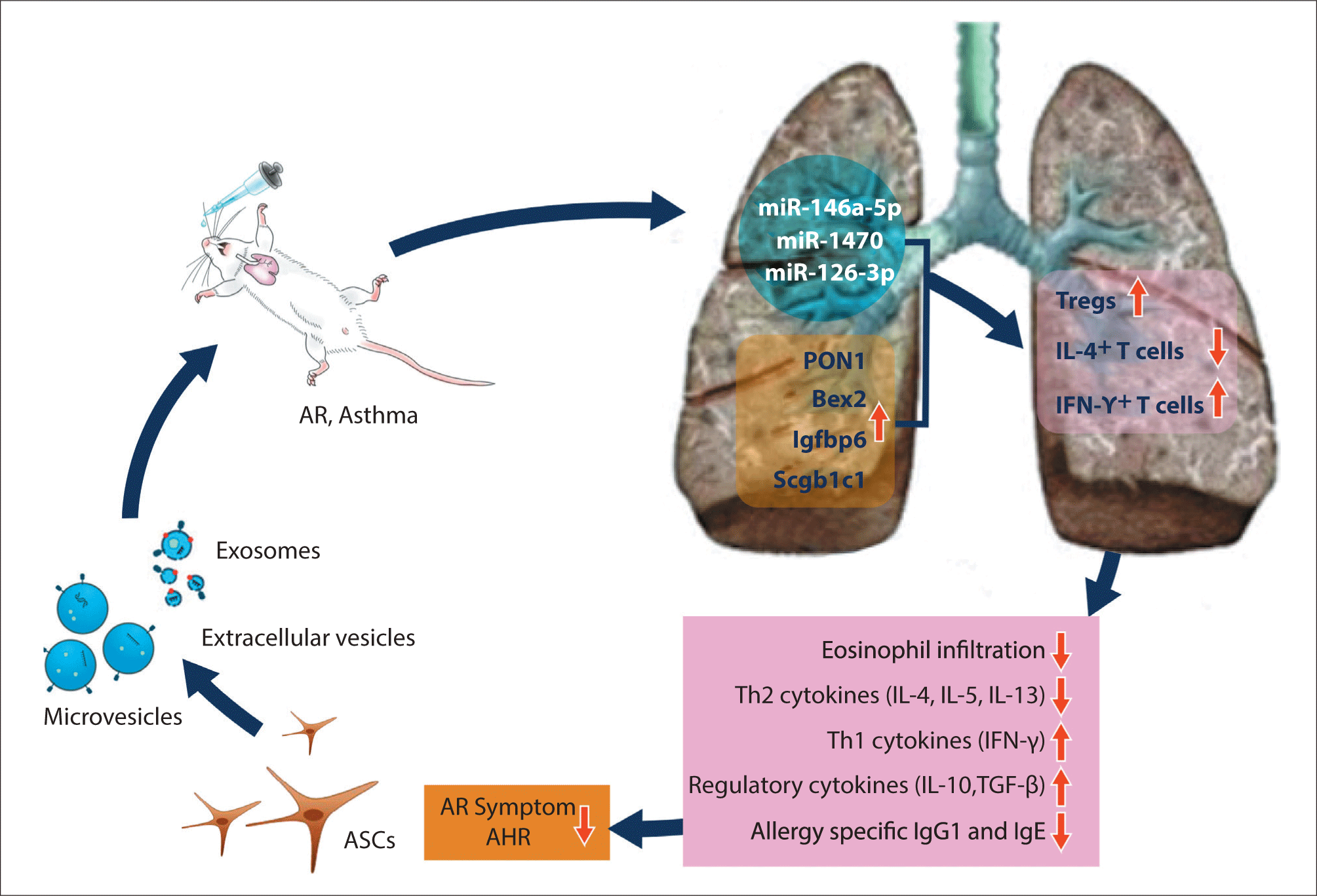
최근 연구에서 줄기세포 배양액(conditioned media)과 줄기세포 배양액에 포함되어 있는 세포외 소포체가 알레르기성 기도 질환에서 줄기세포 자체와 동등한 면역 조절 효과를 보였다.11,12) 비강 내로 투여한 지방 줄기세포 배양액과 세포외 소포체는 줄기세포와 동일하게 천식 마우스 모델에서 기도 과민성과 폐 조직에서 호산구의 침윤을 유의하게 감소시켰다. 기관지 폐포 세척액과 폐 주위 림프절에서 알레르겐 유발 후 증가된 IL-4, IL-5, IL-13의 수치는 지방줄기세포 배양액과 세포외 소포체 치료 후 의미있게 감소되었으며 IFN-γ는 증가되었다. 또한 폐 주위 림프절에서 CD4+IL-4+ T세포는 감소되었으며 CD4+ IFN-γ+ T세포와 CD4+CD25+Foxp3+ T세포는 증가하였다. 마우스 지방줄기세포 유래 세포외 소포체의 면역조절 기전에 대한 in vitro 실험에서 세포외 소포체는 미성숙 수지상 세포에서 CD40, CD80, 그리고 CD86의 발현과 대식세포(macrophage)에서 arginase1, CCL22, IL-10, TGF-β와 같은 M2 표지자의 발현을 증가시킴으로써 eotaxin과 IL-10의 발현 감소, TGF-β와 IL-10의 발현 증가를 통해 폐상피세포의 Th2 매개 염증을 감소시켰다.13)
지방줄기세포 유래 세포외 소포체의 알레르기 기도 염증 억제와 연관된 유전자를 확인하기 위해 폐 조직에서 DNA 미세배열(microarray) 분석기술을 시행하였다. 정량적 실시간중합효소연쇄반응(quantitative real-time polymerase chain reaction, qRT-PCR)에서 PON1(paraoxonase 1), Bex2(brain-expressed X-linked 2), Igfbp6(insulin-like growth factor binding protein 6), SCGB1C1(secretoglobin family 1C member 1) 유전자의 발현이 천식 마우스 폐 조직에서 감소 후 지방줄기세포 유래 세포외 소포체 치료 후 유의하게 증가하였다.14) 또한 PON1과 SCGB1C1 단백질을 치료 물질로 비강 내로 투여하였을 때 지방줄기세포 배양액과 세포외 소포체를 투여 시와 동등한 알레르기 염증 억제효과를 보였다. 이러한 결과는 PON1과 SCGB1C1이 천식 마우스 모델에서 기도 재형성과 호산구성 기도 염증을 감소시킬 수 있다는 것을 의미하며, 지방줄기세포 유래 세포외 소포체의 알레르기성 기도 질환에 대한 면역조절효과의 기전에 연관이 있을 가능성이 높다고 생각된다. 결론적으로 알레르기 기도 질환에서 지방줄기세포 배양액과 세포외 소포체에 의한 면역 조절 효과 기전은 비강 내로 투여된 배양액과 세포외 소포체에 포함된 microRNA(miR-146a-5p, miR-1470, miR-126-3p)와 PON1, Bex2, Igfbp6, SCGB1C1과 같이 증가된 유전자가 조절 T세포의 증가와 IL-4 양성 T세포의 감소, 그리고 IFN-γ 양성 T세포를 증가시켜 결과적으로 폐 조직에서 호산구의 침윤과 IL-4, IL-5, IL-13과 같은 Th2 사이토카인, 그리고 알레르겐 특이 면역글로불린 E와 G1을 감소시키고, Th1 사이토카인과 IL-10, TGF-β와 같은 조절 사이토카인을 증가시켜 알레르기 비염의 증상과 기도과민성을 호전시킨다고 제시하였다(Fig. 2).15)
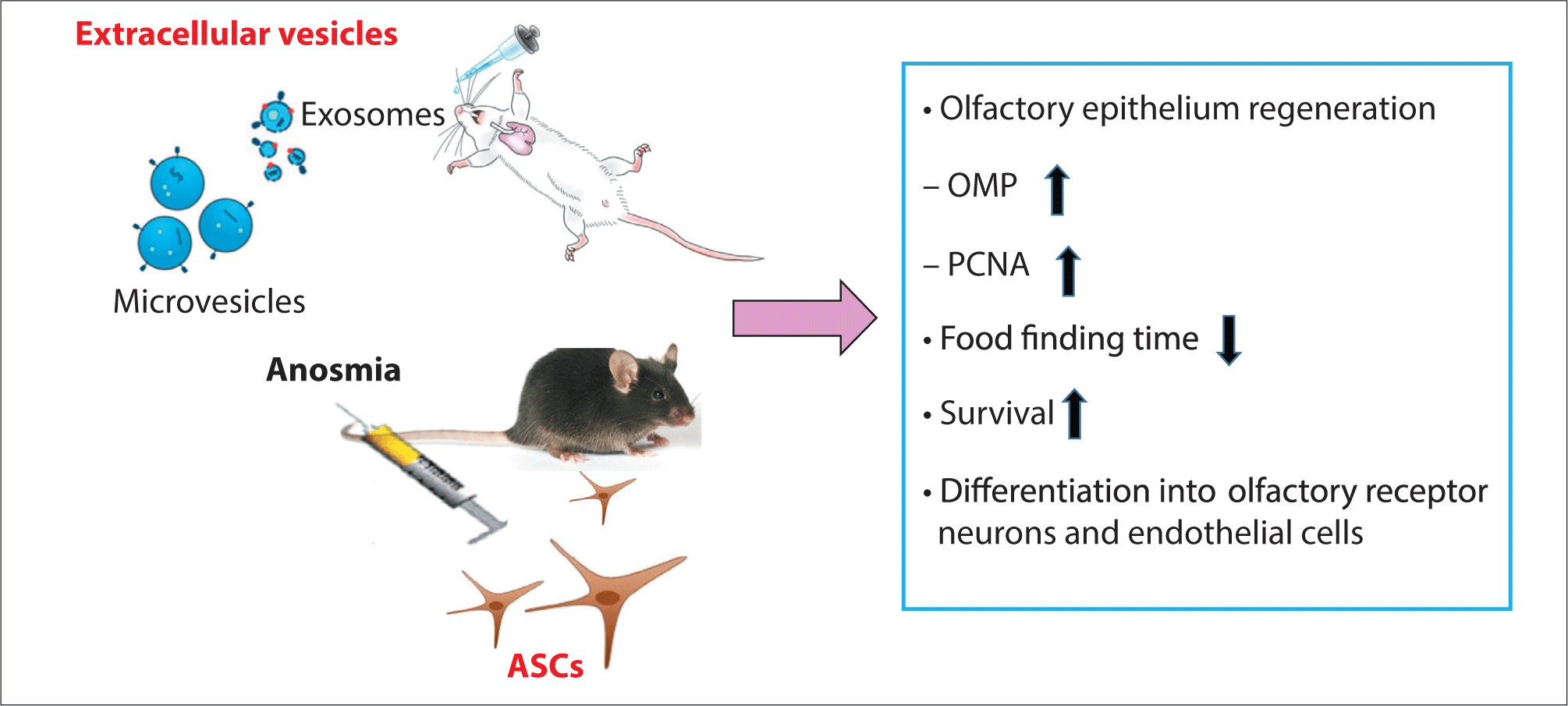
후각 장애는 감각 기관의 가장 흔한 질환 중 하나로 삶의 질과 밀접하게 관련되어 있다. 후각에 대한 분자학적 기전은 최근에 밝혀졌지만 후각 장애에 대한 병태생리학 기전 및 효과적인 치료법은 여전히 어려운 과제로 남아 있다.1) 후각 손상은 비부비동염, 상기도 감염, 두부 외상에서 코의 후각 수용체 뉴런의 퇴화와 후각 피질의 후각 구근(olfactory bulb)의 퇴화로 인해 발생할 수 있다. 후각 상피는 중추신경계 중 유일하게 외부에 노출되어 있고 재생이 가능한 부분이다. 상피의 고유층 바로 위에 있는 기제세포(basal cell)가 줄기세포로 후각수용세포(olfactory receptor cell) 손상이 되었을 때 이것으로 분화되므로 이 세포의 양적, 기능적 회복이 치료에 있어 중요하다고 할 수 있다.
일측 후각 신경을 절단하여 후각 상피 변성을 초래한 무후각증 쥐 모델에서 지방유래 줄기세포를 정맥으로 주사한 후 1달 뒤 후각 상피에서 후각표지단백(olfactory marker protein, OMP)과 증식세포핵항원(proliferating cell nuclear antigen)의 발현이 증가되었으며 이식된 줄기세포가 내피세포와 신경세포로 분화되는 것을 확인할 수 있었다.16) 3-methylindole의 복강 내 주사에 의해 후각 소실을 유도한 마우스에 비강 내로 줄기세포 유래 분비체를 투여한 후 2주차에 시행한 음식 탐색 검사(food finding test)에서 후각 기능이 향상되었으며, 조직 검사와 면역형광염색에서 후각 상피의 두께가 증가하고 OMP의 발현이 증가되었다(Fig. 3). 따라서 줄기세포와 줄기세포 분비체는 여러 가지 성장인자를 통해 후각 신경의 재생을 초래하며 후각 장애의 치료에 있어서 줄기세포에 관한 연구가 새로운 치료 방법을 제시해 줄 수 있으리라 생각된다.
비용은 비부비동 점막 상피에서 발생하는 만성 염증성 결과물로 흔히 중비도와 사골동에 발생한다. 비폐색, 비루, 후각의 감소와 미각의 변화, 두통 등의 증상을 초래할 수 있고 삶의 질을 감소시킬 수 있다.1) 비용의 원인과 발생 기전에 대해서는 아직 명확하지 않으며 비용을 동반한 만성 비부비동염의 치료도 아직은 미해결 과제로 남아 있다. 비용은 만성 비부비동염에 동반되어 나타날 뿐만 아니라 천식, 알레르기비염, 아스피린 과민증, 낭성섬유증 등 전신 질환과 동반되어 나타나는 경우가 흔하다. 조직학적으로 비용은 점막 고유층의 심한 부종과 상피 내 배상세포(goblet cell) 증식, 기저층의 비후와 호산구, 비만세포, 임파구, 호중구, 형질세포 등 다양한 염증세포의 침윤을 특징으로 한다.1,17) 호산구성 비용의 경우, 기질 내 다수의 호산구와 활성화된 비만세포가 관찰되고 기질의 부종이 동반되며, 다양한 사이토카인이 작용하지만 특히 IL-4, IL-5의 증가와 함께 Th2 면역 반응이 주된 작용을 하는 것으로 알려져 있다.17)
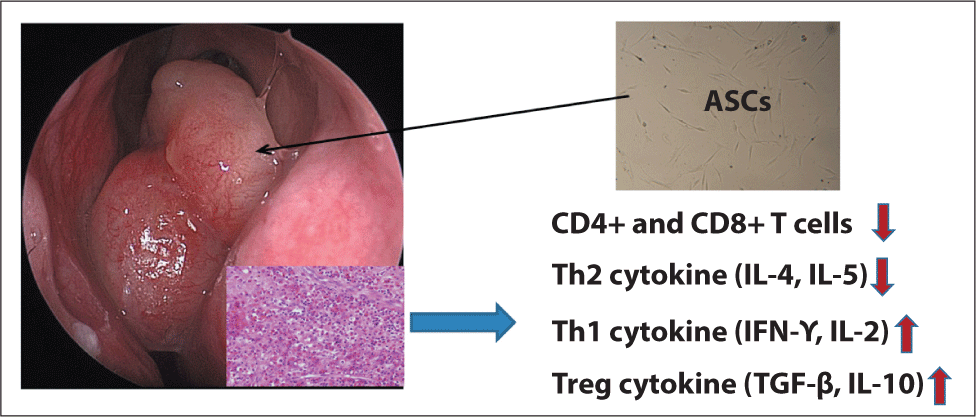
호산구성 비용을 동반한 만성 비부비동염 환자 20명에서 비용 조직을 채취한 후 비용 조직에 침윤되어 있는 세포들을 분리하여 복부 지방에서 분리 배양한 줄기세포와 함께 배양하여 비용 조직에서 T 림프구의 분획과 사이토카인의 발현 양상을 비교 분석하였다.17) 호산구성 비용에서 지방유래 줄기세포는 CD4+와 CD8+ T세포와 Th2 사이토카인(IL-4, IL-5)을 유의하게 감소시켰으며, Th1 사이토카인(IFN-γ, IL-2)과 조절 사이토카인(TGF-β, IL-10)을 유의하게 증가시켰다.17) 본 연구 결과를 통해 호산구성 비용 조직에서 지방유래 줄기세포는 활성화된 T세포와 Th2 면역 반응을 하향 조절함으로써 면역 조절 효과를 보이는 것을 확인할 수 있었다(Fig. 4). 하지만 본 연구는 in vitro 연구이기 때문에 in vivo에서도 같은 결과를 보이는 지 확인하고자 호산구성 비용을 동반한 만성 부비동염 마우스 모델에서 지방줄기세포 유래 분비체의 치료 효과를 확인하였다.
BALB/c 마우스에 12주에 걸쳐 3% OVA(ovalbumin)으로 비강내 자극을 하고, 초항원으로 작용할 수 있는 포도상구균 장독소(staphylococcal enterotoxin B)를 12주 기간 중 후반 8주에 걸쳐 비강내 투여하면 호산구성 비용을 동반한 만성 부비동염 마우스 모델이 유도된다. 이 모델에 마우스 지방유래 줄기세포 배양액을 실험 후반 8주 동안 주 3회 비강 내로 투여하여 치료 효과를 분석하였다. 치료군이 대조군에 비해 조직검사 상 비용종 병변이 감소하였고, 호산구 침윤 정도도 감소하였다. 비강 점막에 대한 qRT-PCR 검사에서 eotaxin의 유의한 감소가 확인되었으며 IL-8의 감소도 확인되었다. 또한 비강 점막에 대한 ELISA 검사 상 치료군에서 IL-4, IL-5가 유의하게 감소하였고, IL-8, IL-13도 감소하는 양상으로 나타났다(data not shown).
줄기세포 유래 세포외 소포체를 포함한 분비체는 기존의 줄기세포 치료제의 단점을 보완하면서 유사한 치료 효과를 보여 많은 연구들이 진행되고 있다. 특히 조직 재생 및 면역조절 치료제로서의 효과에 대해 많은 보고가 이루어지고 있지만, 실제 환자에게 치료적으로 사용을 하려면 여전히 많은 제약과 한계점이 존재한다. 먼저 충분한 효과를 보장할 고농도의 대규모 중간엽줄기세포 유래 세포외 소포체를 확보하는 문제이다. 세포외 소포체는 중간엽줄기세포의 배양배지로부터 분리되기 때문에 줄기세포의 수, 배지의 부피와 세포외 소포체를 분리하는 시기를 포함한 배양 조건은 세포외 소포체의 양뿐만 아니라 질적인 부분 모두에서 영향을 미칠 수 있으므로 매우 중요하다. 또한 중간엽줄기세포 유래 세포외 소포체를 배양배지에서 분리하는 여러 방법들이 소개되고 있지만 이러한 다양한 방법들에 대한 최적화가 선행되어야 하며 과정에 대한 적절한 규제 또한 필요하다.
다양한 질병에 대한 중간엽줄기세포유래 세포외 소포체의 안정성과 효능에 대한 임상 평가가 시행되어야 하고 이론적인 결과를 뒷받침 해줄 수 있는 정확한 작용 기전에 대한 연구가 시행되어야 한다. 줄기세포 유래 세포외 소포체를 포함한 분비체에는 단백질, 지질, 리보핵산 등으로 다양한 성분들이 구성되어 있어 품질관리에 많은 어려움이 있다. 그러므로 국내외적으로 줄기세포 유래 분비체의 품질평가 가이드라인도 명확하게 확립이 되어야 할 것으로 생각한다.
결론
줄기세포와 줄기세포 유래 세포외 소포체는 자가 분열 능력, 분화 능력, 면역 조절 기능으로 임상의 다양한 분야에서 장기 및 조직의 손상에 대한 기능 회복을 목표로 활발한 연구가 진행되고 있다. 최근에는 이비인후과의 다양한 질환에서 줄기세포를 이용한 치료법에 대한 연구가 진행되어 많은 연구 성과들이 나오고 있다. 또한 줄기세포 자체뿐 아니라 줄기세포 유래 세포외 소포체를 포함한 분비 물질들에 대한 기초 생물학 및 이식 치료 연구가 빠른 속도로 발전하고 있어 향후 실제 임상에서 사용 가능할 것으로 생각한다. 특히 비과 분야에서 알레르기 기도 질환, 후각 장애, 호산구성 비용을 동반한 만성 비부비동염과 같은 난치성 질환에 줄기세포를 이용한 치료가 치료 방향의 패러다임을 바꾸고 환자들의 삶의 질을 향상시킬 수 있으리라 기대한다.






