서론
비부비동에 발생하는 도립유두종은 병리조직학적 스펙트럼이 넓으며 따라서 임상 양상도 다양하다. 단순한 양성 종물의 양상을 보이기도 하지만, 편평상피암을 동반하는 악성 종양의 양상을 보이기도 한다. 종물이 자라면서 단순히 비부비동의 공간만을 점유하는 양상을 보이기도 하지만, 어떤 경우에는 주위 조직에 침윤(infiltration)되고 유착하는 양상을 보이기도 한다. 병리조직학적으로는 편평화생(squamous metaplasia)을 동반한 염증성 폴립(inflammatory polyp)으로 보이기도 하고 어떤 경우에는 기질 안으로 도립된 편평상피 나아가 경도-증등도-고도에 이르는 이형성(dysplasia)을 동반한 종물 형태를 보이기도 한다. 심지어는 완연히 편평상피암의 형태를 보이기도 한다.1–3)
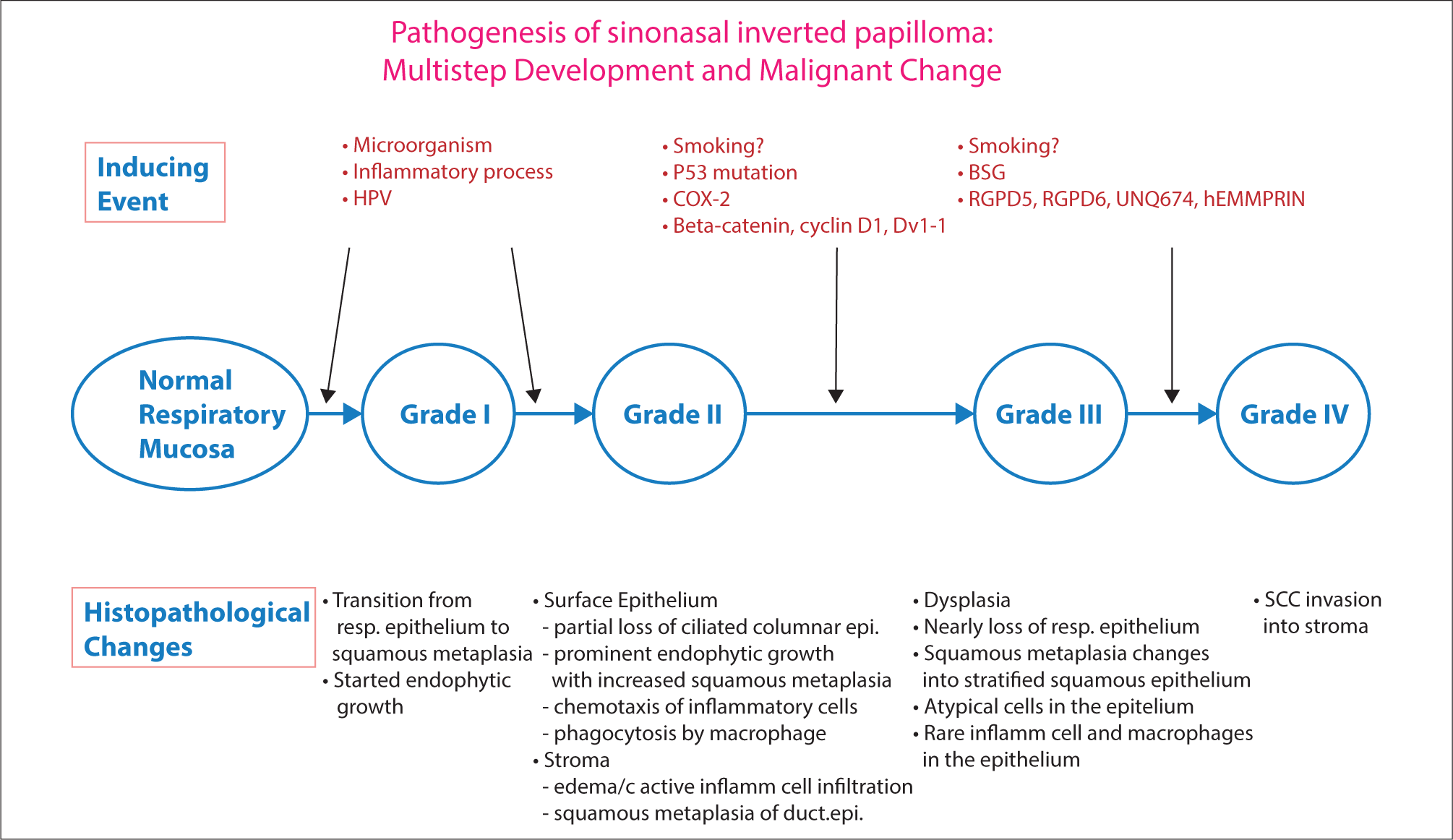
비부비동 상피는 호흡기에 속하므로 기관지나 폐처럼 섬모를 가진 위증층 원주상피(pseudostratified ciliated columnar epithelium)이다. 통상 소화호흡기에 속하는 두경부암은 대부분 편평상피암으로서, 발생 기전은 호흡기 원주상피에서 시작하여 편평화생의 변화를 거쳐 이형성 그리고 최종적으론 편평상피암으로 발전하는 다단계 과정을 거친다. 도립유두종의 병리조직학적 스펙트럼이 이와 유사하므로, 도립유두종도 두경부암과 마찬가지의 다단계 발전 과정을 거칠 수 있다고 가정을 해볼 수 있다.3,4)
지금까지 많은 연구들은 도립유두종의 종양적인 특성을 주로 보고하고 있다. 여기에는 세포증식(proliferation)과 세포자살(apoptosis) 사이가 조절되어야 함에도 불구하고 조절되지 않아 세포가 증식하는데 관여하는 각종 유전자 내지 표지자의 발현, 세포의 형태와 안정성에 관여하는 다양한 인자의 비정상 발현, 종양억제유전자의 변이나 발암유전자의 발현 등이다.2-4)
한편, 도립유두종이 염증의 특성을 가지고 있다는 연구 혹은 임상 양상은 많다.3-5) 편측 악성종양에 비하여 편측 도립유두종의 경우 전산화 단층촬영에서 양측에 부비동의 연부조직음영이 의미있게 많다는 연구, 도립유두종으로 병리조직학적 판정을 받기 전인 과거 수술에서 폴립제거술을 받았다는 과거력, 수술 후 국소 재발한 작은 도립유두종의 병소가 추적관찰 중 국소스테로이드에 반응을 보여 재발 병소가 사라진 사례 등 다양하다.4,5) 비부비동에 발생하는 유두종은 WHO 분류에 따르면 3가지 종류이다. 외장성(exophytic or everted), 원주형(cylindrical), 도립(inverted) 유두종이다.2,3,6) 병리학자 Michael과 Young에 의하면 외장성과 원주형 유두종은 진성으로 유두종이지만, 도립유두종은 편평화생을 가진 염증성 폴립의 성격이며 종양의 특성을 너무 지나치게 강조하는 측면이 있다고 하였다.3)
도립유두종이 앞에서 기술한 두 가지 특성 즉, 종양과 염증의 성격을 모두 갖고 있다는 사실로부터 다음과 같은 질문을 할 수 있다. 첫째, 어떻게 도립유두종은 폴립과 같은 양성 종물에서부터 편평상피암과 같은 악성 종양까지 다이내믹한 병리조직학적 스펙트럼을 가질 수 있는가? 둘째, 도립유두종이 종양의 성격을 갖기 전인 발생 초기에 염증 과정이 관여하는가? 한다면 이를 뒷받침하는 병리조직학적 단서는 있는가? 셋째, 인간유두종바이러스(human papilloma virus, HPV)가 도립유두종의 발생에 관여하는가? 만일 관여한다면 발생의 어느 단계에 관여하는가? 또 어떤 아형(subtype)이 관여하는가? 그리고 HPV가 재발에도 영향을 미치는가? 넷째, 두경부암의 가정 흔한 원인인 흡연이 도립유두종의 악성 변화에도 기여하는가? 그리고 흡연이 재발에도 영향을 미치는가? 다섯째, 양성에서 악성으로 진행하기 위해선 어떤 유도 변화(inducing event)들이 있는가? 그리고 이런 유도 변화가 축적되면 이에 상응하는 병리조직학적 표현형 변화(phenotypic event)는 무엇인가?
Roh 등은 위와 같은 질문에 대한 답을 구하고자 다수의 연구를 진행하였다. 이런 연구 결과들을 바탕으로 도립유두종이 양성에서 시작하여 악성 변화에 이르기까지 다단계로 발전하는 모델을 제시하고자 한다.
본론
이 보고는 도립유두종 발생 초기에 염증의 역할을 규명한 연구이다.5) 비부비동에 발생한 총 41례 유두종은 외장성, 원주형, 도립형이 각각 14, 2, 25례였다. 이 중 도립유두종은 일련의 단계적인(stepwise series) 조직학적 변화를 거치면서 악성으로 발전하는 것으로 알려져 있다. 즉, 섬모를 가진 정상원주상피에서 시작하여 점점 편평화생을 가진 상피로 치환되고 종국에는 편평상피로 바뀌며, 기질 속으로 도립(inverted)된다. 더 진행되면 이형성이 생기고 결국 최종적으로 편평상피임으로 발전한다.3,4) 그러므로 본 연구에서는 이런 일련의 조직학적 변화가 맞는지를 확인하고자 다양한 변수를 분석하였다(Table 1). 이 분석에 따라 도립유두종을 4가지 병리조직학적 등급(pathological grade)으로 나눌 수 있었으며, 그 특성은 Table 2와 같이 파악할 수 있었다. Grade I 과 grade II는 이형성이 생기기 전 단계이므로 양성 도립유두종(benign IP)이고, grade III는 이형성을 동반하므로 이형성 도립유두종(dysplastic IP), grade IV는 편평상피암종으로 변화하였으므로 악성 도립유두종(IP with SCC)라고 요약할 수 있다.
Adopted from Roh et al.4) with permission of John Wiley & Sons.
Adopted from Roh et al.4) with permission of John Wiley & Sons.
모든 유두종의 상피에 염증세포와 대식세포(macrophage)가 얼마나 많이 침윤되어 있는지 고배율시야(high power field) 하에서 분석하였다. 염증세포는 외장성 유두종에 비하여 도립유두종에서 의미 있게 증가하였으며, 대식세포는 외장성이나 원주형 유두종의 상피에서는 아예 존재하지도 않았다(Table 3). 이 결과는 외장성이나 원주형 유두종에 비하여 도립유두종의 병인에 염증 과정이 관여하고 있음을 의미한다. 그래서 염증 과정이 어느 정도 관여하는지를 병리조직학적 등급(grade)에 따라 분석하였다. 염증세포와 대식세포는 grade I과 grade II에서 grade III과 grade IV에 비하여 의의 있게 증가하였다. 특히 염증세포는 grade III에 비하여 grade II에서 유의하게 증가를 보여 grade II와 grade III 사이에 의미 있는 차이를 보였다(Table 4). 즉 발생 초기인 grade 1과 grade II에서는 염증 과정이 관여하고 이형성이 나타나는 grade III부터는 종양 과정이 관여함을 시사하였다.
| IP | Everted | Cylindrical | |
|---|---|---|---|
| Inflammatory cells | 14.05±13.05* | 0.91±1.89* | 3.80±2.48 |
| Macrophages | 1.56±2.24 | 0 | 0 |
Adopted from Roh et al.4) with permission of John Wiley & Sons.
| Grade I | Grade II | Grade III | Grade IV | |
|---|---|---|---|---|
| Inflammatory cells | 22.05±13.83* | 17.21±12.70*,† | 7.97±9.06*,† | 0.73±0.79* |
| Macrophages | 2.80±3.44‡ | 1.80±2.08‡ | 0.88±0.01‡ | 0‡ |
Adopted from Roh et al.4) with permission of John Wiley & Sons.
HPV 감염이 도립유두종 발생에 연관되어 있다는 보고는 있지만, 발생의 어느 단계에서 일어나며 또 어떤 HPV 아형이 관여하는지를 정확하게 분석된 보고는 없다. 왜냐하면 기존 연구에서 사용된 조직 샘플들은 grade I에서 IV까지 혼재된 것을 사용했기 때문이다. Type 16이나 18과 같은 고위험(high-risk) 아형이 발현된다는 보고가 있는 반면에, HPV DNA를 발견할 수 없었다는 보고까지 있다.7-10) 흥미 있는 사실은 HPV는 방어 작용을 가지는 섬모와 점액질 담요(mucous blanket)를 가진 정상 호흡원주상피 안으로 쉽게 침입할 수 없다. 침입하기 위해서는 원주상피가 편평화생과 같은 변화가 있을 때 가능하다. 그러므로 도립유두종의 발생 초기에 편평화생과 같은 변화를 초래하는 염증 과정(inflammatory process)이 있다면 HPV 감염이 일어날 가능성이 높을 것이라는 추론이 가능하다. 호흡기에서 편평화생은 암의 전단계(premalignant lesion)라고 보고되고 있다.11) 초기에 호흡기 원주상피의 일부분에서 편평화생이 생기면 타고난 면역(innate immunity) 등 방어 작용의 가능을 가진 정상 호흡상피로서의 기능을 소실된다. 여기에 세포 주기 조절에 관여하는 인자 혹은 세포 생명에 중요한 인자에 변형을 초래하는 침해(insults)가 계속해서 축적된다면 양성 등급에서 이형성 및 악성 등급으로 변화할 수 있음을 또한 추론할 수 있다.
HPV 감염이 도립유두종의 병인에 중요하며, 양성에서 악성으로 변화하는데 관여하며 재발에도 연관되어 있다는 연구 등 다양한 보고가 있다.8-10) 그렇지만 HPV 감염이 도립유두종의 발생에 필수 조건은 아니다. 왜냐하면 도립유두종에서 HPV DNA의 검출 빈도는 0%에서 63%에 이를 정도로 폭이 넓기 때문이다.7-10) 기존 HPV DNA 검출에 관한 연구의 문제점은 채택된 조직 샘플이 grade I, II, III는 물론이고, 심지어 IV까지 함유된 이질성(heterogeneity)을 가지고 있었다는 것이다. 예를 들어 type 16이나 18과 같은 고위험 아형이 발현되므로 양성에서 악성으로의 변환하는데 HPV가 관여한다고 결론을 낸 연구의 조직 샘플에서 이형성의 grade III뿐만 아니라 편평화생을 가진 grade I이나 편평상피화로 진행된 grade II 병소를 포함하고 있다면 도대체 어떤 병리조직학적 단계(등급)에서 HPV가 발현되었는지를 정확하게 알 수 없다. 그러므로 고위험 아형이 악성 변환에 관여한다고 결론을 쉽게 낼 수 없다. 따라서 HPV 감염이 병리조직학적 어느 단계에서 일어나는지를 파악하려면 조직 샘플에서 각 등급을 정확히 구분한 다음 해당 등급의 부위만의 조직을 분리하고 HPV DNA를 검출하는 방법이 필요하다. 이에 저자들은 레이저 포획 미세절제술(laser capture microdissection, LCM) 방법을 사용하여 조직 샘플에 포함된 여러 등급의 병소를 정확히 구분하고 각 등급의 DNA를 추출하여 DNA microarray(DNA chip) 기법을 이용해서 HPV DNA를 검출하였다.12) 그 결과 57개 샘플 중에 7개에서 HPV DNA가 검출되어 12.3%의 HPV 양성률을 보였다. 7개 샘플 모두는 grade I이나 II 같은 초기 등급에서 양성을 보였으며 grade III이나 IV 같은 후기 등급에서는 HPV DNA가 검출되지 않았다. 양성을 보인 7개 샘플 중 5개는 고위험 아형이었고 2개는 비특이 아형이었다(Table 5).
Adopted from Kim et al.12) with permission of Sage.
이런 결과는 저위험 아형은 초기인 양성 도립유두종에서, 고위험 아형은 이형성 혹은 악성으로 변환된 도립유두종에서 검출된다는 기존 연구와 다르다, 즉 본 연구에서는 고위험 아형이 양성 단계에서 검출되고 이형성이나 악성 단계에서는 어떤 아형도 검출되지 않았다, 이렇게 기존 연구 결과와 달랐던 이유는 HPV 검출에 사용한 방법이 달랐기 때문으로 사료된다. 기존 연구들은 PCR 기법 혹은 in situ hybridization 기법을 사용하여 grade I에서부터 IV까지 함유된 이질성의 조직 샘플에 적용했지만, 본 연구는 병리조직학적으로 단계를 정확히 구분하고 정확히 LCM 기법으로 해당 단계만 분리하여 HPV DNA를 검출했기 때문에 본 연구 결과로서 더 정확하게 어떤 아형이 어느 단계에서 검출되는지를 알 수 있다. 결론적으로 HPV 감염은 주로 고위험 아형으로서, 이형성이나 악성 단계가 아니라, 초기인 양성 단계(grade I, II)에서 일어남을 알 수 있었다.
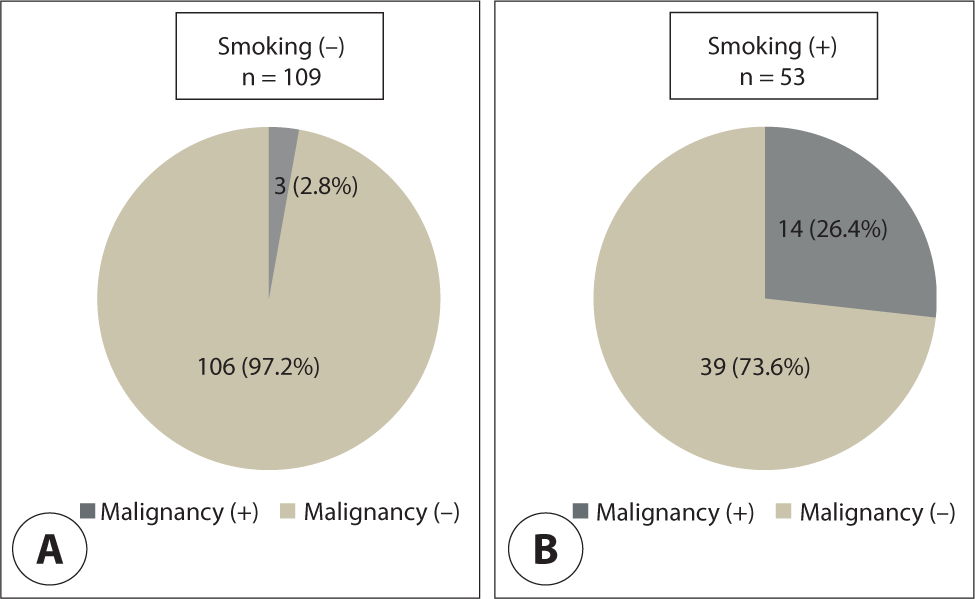
두경부암과 같이 흡연이 도립유두종의 악성 변화에 관여하는지 분석하였다.13) 총 162명의 환자를 분석하였으며, 17례(10.5%)에서 악성종양을 동시(synchronous) 혹은 후에(metachronous) 동반하였다. 162명 중 흡연자는 53례였으며, 이 중 14례(26.4%)에서 악성종양을 동반하였다. 비흡연자는 109례였으며, 이 중 3례(2.8%)에서만 악성종양의 변화를 보였다. 양자 간에 오즈비(odds ratio)는 12.7로서 의의 있는 차이를 보였다(p<0.001). 따라서 결론적으로 흡연이 도립유두종의 악성 변화에 관련 있음을 보여주었고, 흡연 경력이 있는 도립유두종 환자는 수술 후에도 더 장기적인 더 밀접한 추적관찰이 필요함을 시사하였다(Fig. 1).13)
흡연이 악성 변화에 관여하지만 재발에도 관여하는지에 대한 보고는 없다. 또한 HPV 감염이 재발에 관여하는지에 대한 연구도 없다. 저자들은 흡연과 HPV 감염이 도립유두종 수술 후 재발에 관여하는지 총 54명의 환자를 분석하였으며, 결론적으로 HPV 감염은 재발과 연관이 없지만, 흡연은 재발과 관련이 있음을 제시하였다.14)
인체 몇 가지 암은 염증에서 발전하여 암으로 진행한다고 알려져 있다.15,16) 대표적인 것이 위장관 암이며 그 중에서 대장암 모델은 잘 알려져 있다. 대장 용종은 비록 염증성 질환이지만 대장암으로 발전할 수 있으므로 흔히 건강검진에서 조기에 제거할 것을 권유한다. 비부비동에 발생하는 도립유두종도 앞에서 기술한 바와 같이 섬모원주상피를 가진 정상 호흡기에서 감염이나 염증 과정을 거쳐 편평화생을 가진 염증성 용종(grade I)으로 변화하며 이어 편평상피화가 진행하고 기질 안으로 도립된 양성종양(grade II)으로 발전한다. 여기에 세포증식-고사에 관여하는 다양한 인자의 변형 같은 변화들이 계속 축적되면 이형성을 지나 악성종양으로 발전한다. 대장암 모델과 유사하다. 염증에서 시작된 변화가 악성으로 진행하기 위하여 염증-악성 사이의 다리를 연결시키는 연결분자(bridge molecules)로 잘 알려진 COX-2(cyclooxygenase-2)와 NFKB(nuclear factor kB)가 관여한다고 알려져 있다.15)
세포증식-세포고사 사이의 균형이 중요하며 이 균형이 무너졌을 때 악성 변화가 일어난다. 세포 주기(cell cycle)에서 p53이 대표적으로 이 균형을 조절하는 인자로 알려져 있다. 만일 p53의 변형(mutation)이 초래되면 세포 주기의 제어와 조절이 안되어 세포증식이 초래된다. 두경부암에서는 p53의 상태 즉 정상(wild)인지 변형(mutant)인지 그 상태에 따라 COX-2 발현이 좌우된다. 정상형 p53은 COX-2의 전사(transcription)를 억제하지만, 변형 p53은 COX-2의 전사를 향상시켜 발현을 증가시킨다. 즉 COX-2 발현이 높은 것과 p53 변형은 상관관계에 있다.15) 한편, 세포고사에는 bcl-2가 항고사인자(antiapoptotic factor), bax는 전고사인자(proapoptoic factor)로 관여하는 것으로 알려져 있다.16)
저자들은 염증-암 연결 인자인 COX-2와 NFKB, 세포주기의 조절 인자인 p53, 세포고사의 관여 인자로 bcl-2와 bax를 분석하였다.16) 그 결과, COX-2는 도립유두종의 병리조직학적 등급이 올라갈수록 높은 발현을 보여 등급과 의의 있는 상관관계를 보였다. p53 변형은 이형성 이상의 고등급(grade III, IV)에서만 발현을 보이고 저등급(grade I, II)에서는 보이질 않았다. 즉 COX-2와 p53은 저등급보다는 고등급에서 발현이 높았고 흥미롭게도 grade II 병소라도 p53 발현이 높은 grade III 근처에 위치한 곳이 그렇지 않은 곳에 비하여 COX-2 발현이 높은 것을 미루어 볼 때 COX-2 발현은 이형성 단계에서 중요한 역할을 할 것으로 추정된다. 이런 결과는 p53 변형이 양성에서 악성으로 변화하는데 중요한 역할을 하고, COX-2가 매개하는 염증 신호 또한 저등급에서 고등급으로 발전하는데 공헌함을 시사한다. 또 다른 연결분자인 NFKB 및 세포고사에 관여하는 bcl-2와 bax의 발현은 등급과 상관 관계를 보이질 않았다(Table 6).
Wnt 신호경로(signaling pathway)가 암의 발생에 중요한 역할을 한다고 최근 알려져 있다.17,18) Wnt 신호경로 물질들은 여러 개의 신호전달 당단백으로 구성된 망(network of multiple signaling glycoprotein)을 형성하며 여기에는 Wnt-1, beta-catenin, cyclin D1, Dishevelled-1(Dvl-1)이 있다. Wnt 신호경로 물질들은 배아발생(embryogenesis) 같은 정상적인 생리 과정에 관여하지만 식도암, 위암 등 악성종양에도 관여한다고 알려져 있다. 본 연구는 총 115개의 조직 샘플에서 조직 핵심 미세배열(tissue core microarray) 기법을 사용하여 Wnt 신호경로 물질들의 발현과 병리조직학적 등급 사이에 어떤 상관관계가 있는지 분석하였다.18) 그 결과, Wnt-1을 제외한 beta-catenin, cyclin D1, Dvl-1의 발현이 병리조직학적 등급과 유의미한 상관관계를 가지고 있음을 보여주었다(Table 7). 이런 결과는 Wnt 신호경로가 도립유두종의 악성 변화에 중요한 역할을 함을 시사하였다.
Adopted from Jung et al.18) with permission of Sage.
도립유두종이 악성 변화를 하는데 이때까지 보고되지 않은 또 다른 어떤 유전자의 변이가 관여하는지를 예측하고자 비교 유전체 하이브리드(microarray comparative genome hybridization, aCGH) 기법을 사용하여 복제수 변이(copy number variation, CNV)와 복제수 변이 지역(copy number variation regions, CNVRs)을 분석하였다.19) aCGH 기법으로 분석하면 유전자의 증가(gain) 혹은 분실(loss)을 알 수 있다. 증가는 해당 CNVRs 에 발암유전자(oncogene)가, 분실은 종양억제유전자(tumor suppressor gene)가 있을 가능성을 암시한다.
그 결과, 통계적으로 의의 있는 CNV와 CNVRs을 알 수 있었다(Table 8). 여기서 표기된 CNV 모두가 악성 변화에 관여하는 유의미한 발암유전자 혹은 종양억제유전자로서 가능성이 있다는 것은 아니다. 그러나 여태까지 암 발생과 연관되어 있다고 알려진 수많은 유전 정보를 종합하여 고려하면 염색체 2q13의 분실(loss at 2q13), 염색체 9p13.3의 증가(gain at 9p13.3), 염색체 19p13.3의 증가(gain at 19p13.3)가 의미 있는 CNVRs이라 사료된다. 특히 염색체 2q13에서는 RGPD5와 RGPD6이 종양억제유전자로서, 염색체 9p13.3에서는 CA9이 발암유전자로서, 염색체 19p13.3에서는 BSG와 PRSSL1이 발암유전자로서 가능성 있음을 제시하였다. 향후 이들이 실제로 도립유두종의 악성 변화를 예측하는 유전자로서 가능성이 있는지는 향후 더 연구할 과제이다.
Adopted from Shin et al.19) with permission of e-century.
결론
도립유두종은 발생과 악성 변화는 다단계 과정을 거친다. 초기는 양성종양 단계(grade I, II)로서 감염과 염증과정이 관여한다. 여기에 다양한 변형과 침해가 축적되면 이형성(grade III) 단계로, 더 계속 축적되면 악성(grade IV)으로 변화한다. 저자들은 이런 발생 기전을 밝힌 저자들의 연구 결과들을 종합하여 도립유두종의 발생과 악성 변화로 나아가는 다단계 발전의 가설(Fig. 2)을 제시한다.